Thalidomide - Thảm họa đen tối nhất lịch sử y dược thế giới
Theo dõi Báo Bình Dương trên

Vụ bê bối được xem là thảm họa ấy xảy ra cách đây gần 50 năm, với hàng ngàn nạn nhân bị ảnh hưởng, bị dị tật do tác dụng phụ của loại thuốc trị “bá bệnh”. Đã có nhiều phiên tòa được mở liên quan đến vụ bê bối này, nhưng nhà sản xuất thuốc vẫn khăng khăng chối bỏ trách nhiệm của mình. Mãi đến ngày 31-8 vừa qua, nhà sản xuất loại thuốc chứa chất độc hại thalidomide ấy mới chịu đưa ra lời xin lỗi đầu tiên. Nhưng xin lỗi không thôi chưa đủ.
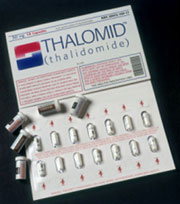 Thuốc
thalidomide với tên thương mại là Thalomid ở Mỹ.Biệt dược thalidomide
Thuốc
thalidomide với tên thương mại là Thalomid ở Mỹ.Biệt dược thalidomide
Thalidomide, tên thương mại là Thalomid (ở Mỹ), Contergan (ở châu Âu) hay Softnon ở Australia, là một loại biệt dược giảm đau, an thần, hỗ trợ giấc ngủ. Thuốc này do Công ty dược Gruenenthal của Đức sản xuất và lưu hành từ cuối thập niên 50 đến đầu thập niên 60 thế kỷ XX. Thuốc do bác sĩ Heinrich Mueckter, thành viên Đức Quốc xã, chủ trì việc nghiên cứu phát minh, chế tạo.
Mueckter là một bác sĩ, nhà nghiên cứu giỏi của Đức thời bấy giờ. Trong Chiến tranh thế giới lần II, ông ta được Hitler giao cho phụ trách Viện Nghiên cứu virus và bệnh sốt Rickettsia ở Krakow để bào chế vắcxin phòng bệnh này.
Ngày 1-10-1957, sau một thời gian nghiên cứu, thử nghiệm, biệt dược thalidomide chính thức được lưu hành trên thị trường y dược. Thời gian đầu, thalidomide đã chứng tỏ năng lực giảm đau, an thần vô cùng hiệu quả và còn được xưng tụng là "thần dược" trong điều trị các chứng bệnh như mất ngủ, ho, cảm lạnh và nhức đầu, được phát hiện có hiệu lực rất tốt với chứng "nôn mửa buổi sáng" của thai phụ thời kỳ "ốm nghén".
Thảm họa ngoài ý muốn
Sau Đức, nước Anh cấp phép cho lưu hành thuốc thalidomide vào năm 1958. Và sau đó thalidomide có mặt tại hàng loạt quốc gia trên thế giới, kể cả có phép và không phép. Ở Mỹ, mặc dù chưa bao giờ được Cơ quan Quản lý Dược - Thưc phẩm (FDA) cấp phép, nhưng thalidomide vẫn được bán và người bệnh vẫn vô tư sử dụng. Các đại lý thuốc tân dược ở Anh thông qua khối Thịnh vượng chung (Commonwealth) phân phối thalidomide đến nhiều nước khác, kể cả Australia xa xôi.
Chỉ trong một thời gian ngắn lưu hành, từ tháng 10-1957 đến đầu năm 1962, thalidomide đã được tiêu thụ tại ít nhất 46 quốc gia trên thế giới, với con số người sử dụng lên đến hàng chục ngàn người, chưa kể khoảng 20.000 người bệnh ở Mỹ đã bị dùng làm vật thí nghiệm dùng thử thuốc thalidomide khi chưa được phép của FDA.
Một thời gian ngắn sau khi thuốc thalidomide được lưu hành, ở châu Âu và nhiều nước bắt đầu xuất hiện những ca sinh non và sinh con dị tật. Chỉ trong 3 năm, số nạn nhân dị tật do dùng thuốc thalidomide gia tăng chóng mặt, và thalidomide đã biến thành thảm họa lớn nhất trong lịch sử ngành y dược thế giới.
Tổng cộng trên toàn thế giới đã có khoảng từ 10.000 đến 20.000 trẻ em sinh ra bị dị tật, khiếm khuyết tay, chân, không tay không chân hoặc bị co rút ngón tay, ngón chân,… Đức là quốc gia đầu tiên lưu hành thalidomide nên có số nạn nhân cao nhất thế giới, với ít nhất là 3.000 người, kế đến là Anh - quốc gia "đại lý" thuốc thalidomide, với ít nhất 2.000 nạn nhân. Trong khi Mỹ, Brazil,… có vài trăm nạn nhân mỗi nước.
 Một nạn
nhân co rút tứ chi do thuốc thalidomide. Nhưng, việc
quy trách nhiệm cho thuốc thalidomide gây ra các dị tật bẩm sinh này là điều
không dễ dàng, vì với kiến thức khoa học hạn hẹp thời đó, giới khoa học không
tin rằng có một loại thuốc nào có thể vượt qua được bức thành nhau thai để gây
hại cho sự phát triển của thai nhi.
Một nạn
nhân co rút tứ chi do thuốc thalidomide. Nhưng, việc
quy trách nhiệm cho thuốc thalidomide gây ra các dị tật bẩm sinh này là điều
không dễ dàng, vì với kiến thức khoa học hạn hẹp thời đó, giới khoa học không
tin rằng có một loại thuốc nào có thể vượt qua được bức thành nhau thai để gây
hại cho sự phát triển của thai nhi.
Rốt cuộc, các nghiên cứu y khoa trong những năm sau khi xuất hiện trẻ sơ sinh dị tật đã chứng minh là do tác hại của thalidomide. Năm 1961, bác sĩ sản khoa William McBride và bác sĩ nhi khoa Widukind Lenz, người Australia, đã chứng minh được mối liên hệ giữa thalidomide với các khuyết tật ở trẻ sơ sinh.
Từ kết quả nghiên cứu của 2 bác sĩ McBride và Lenz, các nước bắt đầu cấm lưu hành thalidomide vào năm 1961. Canada là quốc gia cuối cùng cấm lưu hành thalidomide vào đầu năm 1962. Về sau, bác sĩ McBride đã được Viện Đời sống (L'Institut de la Vie) danh tiếng ở Paris tặng thưởng nhiều giải thưởng do công trình nghiên cứu của mình.
Có sự khác nhau về số lượng nạn nhân giữa các quốc gia trên thế giới là do các quy định y khoa của mỗi nước khác nhau. Nhiều nước không cấp phép lưu hành nhưng cũng không hạn chế việc buôn bán và sử dụng loại thuốc này. Nhưng một số nước khác thì việc sử dụng rất hạn chế.
Ở Mỹ chẳng hạn, các quan chức FDA từ chối cấp phép chính thức lưu hành thalidomide do chưa thể khẳng định tính an toàn khi sử dụng bởi thai phụ, và yêu cầu phải tiến hành nghiên cứu thêm về tác dụng của loại thuốc này.
Ở Austalia, Brazil và New Zealand, thuốc thalidomide chỉ được bán theo toa của bác sĩ, phải được chỉ định của bác sĩ, không được tùy tiện sử dụng. Chính nhờ những sự hạn chế này mà số nạn nhân thalidomide ở Australia, New Zealand, Brazil và Mỹ ít hơn hẳn so với Anh và Đức.
Trong số hơn 10.000 nạn nhân của thuốc thalidomide, có đến gần 8.000 người đã chết trong độ tuổi vị thành niên, còn lại khoảng 5.000 đến 6.000 người còn sống đến ngày nay.
50 năm cho một lời xin lỗi
Mặc dù giới khoa học đã chứng minh được có sự liên quan giữa thuốc thalidomide với các dị tật thai nhi, nhưng điều đó không có nghĩa là Công ty Gruenenthal chịu nhận trách nhiệm ngay. Đại diện Gruenenthal luôn cho rằng mình đã làm hết sức, đã nghiên cứu thật kỹ càng và tuân thủ đúng các nguyên tắc khoa học trong việc nghiên cứu chế tạo thuốc thalidomide.
Thời gian đầu, khi mới xảy tình trạng sinh con dị tật, ở CHDC Đức đã nổ ra một cuộc tranh luận gay gắt xung quanh "thủ phạm" chính gây ra dị tật co rút tay chân. Năm 1958, trước tình trạng trẻ sơ sinh dị tật co rút tay chân ngày càng tăng mạnh, Cơ quan Quản lý y dược CHDC Đức nghi ngờ thalidomide là thủ phạm, nhưng ở phía khác, một số bác sĩ chuyên khoa nhi lại quy trách nhiệm cho phóng xạ hạt nhân trong chiến tranh.
Trong khi đó ở Tây Đức, giới khoa học và chính quyền đều rất thờ ơ với các nạn nhân dị tật do thalidomide. Phải mất một thời gian dài cho đến sau năm 1962, khi Bộ Y tế CHLB Đức ra đời thì vấn đề mới được quan tâm.
Cuộc chiến đòi công bằng của nạn nhân thalidomide đã dẫn đến sự ra đời của nhiều tổ chức, hội hoạt động vì các nạn nhân thalidomide. Kết quả là vào năm 1970, gần 10 năm sau khi thalidomide chính thức bị cấm lưu hành, theo đơn kiện của Hiệp hội Nạn nhân Contergan cùng nhiều tổ chức khác đại diện cho nạn nhân thalidomide, một phiên tòa đã được mở, dẫn đến sự dàn xếp thành lập một quỹ trị giá 150 triệu mác để trợ giúp cho khoảng 3.000 nạn nhân ở Đức. Tuy nhiên, cách dàn xếp này được cho là chưa thỏa đáng, vì chừng ấy tiền cho 3.000 nạn nhân trong khoảng thời gian sống ít nhất 70 năm là không đủ.
Năm 1972, lại thêm một phiên tòa nữa được mở, và với sự chứng minh không thể chối cãi của giới khoa học về một cơ chế gây ra quái thai không tay không chân và co rút tay chân, Công ty Gruenenthal đành phải thừa nhận trước tòa án rằng: “Thalidomide là thủ phạm gây quái thai, sinh con dị tật và "lấy làm tiếc" cho các nạn nhân bị ảnh hưởng bởi thuốc thalidomide”. Mãi đến năm 2009, công ty mới tiếp tục có thêm động thái tích cực là hứa sẽ dành ra một quỹ trị giá 50 triệu euro để hỗ trợ nạn nhân thalidomide.
Tháng 7-2012, một phụ nữ Australia sinh ra không tay không chân sau khi mẹ của bà dùng thuốc thalidomide, đã thắng kiện một nhà phân phối Anh và buộc nhà phân phối này phải bồi thường nhiều triệu USD. Còn khoảng 100 nạn nhân người Australia và New Zealand khác cũng đang đâm đơn kiện và hy vọng sẽ được bồi thường. Tuy nhiên, Công ty Gruenenthal vẫn tiếp tục từ chối bồi thường.
Rốt cuộc, vào ngày 31-8-2012, Tổng Giám đốc Harald Stock đã đại diện Công ty Gruenenthal chính thức đưa ra lời xin lỗi muộn màng đối với các nạn nhân thalidomide trên toàn thế giới. Tuy nhiên, trong lời xin lỗi, ông Stock cũng biện minh rằng: "Tác dụng phụ ngoài ý muốn xảy ra trong một thế giới hoàn toàn khác ngày nay", ám chỉ kiến thức khoa học còn hạn chế. Điều đó khiến các nạn nhân còn sống của thảm họa năm xưa không hài lòng.
Feddie Astbury, nạn nhân 52 tuổi của thalidomide, Chủ tịch Hội Thalidomide UK, cho rằng: "Thật là xấu hổ khi phải mất 50 năm để đưa ra một lời xin lỗi như thế". Phần đông nạn nhân còn lại đều cho rằng, việc Công ty Gruenenthal "xin lỗi" như thế là "vừa chậm trễ vừa không đủ", là sáo rỗng và không có ý nghĩa gì.
Điều mà nhiều nạn nhân thalidomide cần nhất bây giờ không chỉ là lời xin lỗi, mà quan trọng hơn là thái độ nhận trách nhiệm nghiêm túc và kèm theo là một khoản bồi thường xứng đáng để bù đắp những mất mát, thiệt thòi mà các nạn nhân thalidomide đã phải gánh chịu suốt hơn 50 năm qua.
Người ta yêu cầu Công ty Gruenenthal phải thực hiện nhiều hơn lời hứa lập quỹ 50 triệu euro năm 2009, hoặc chí ít các đại lý phân phối thuốc thalidomide cho Gruenenthal cũng phải thể hiện trách nhiệm của mình bằng những khoản bồi thường tương xứng.
Những nghiên cứu "hậu thảm họa"
Hậu quả "tích cực" của thảm họa thalidomide đối với ngành y dược thế giới là nó làm cho nhiều nước phải siết chặt các quy định quản lý ngành dược. Chẳng hạn, vào năm 1962, Quốc hội Mỹ đã thông qua luật bắt buộc phải thử nghiệm độ an toàn dành cho thai phụ trước khi cho phép lưu hành bất kỳ loại thuốc tân dược nào. Sau Mỹ, nhiều nước khác trên thế giới cũng có quy định tương tự.
Mặc dù đã từng gây ra thảm họa, nhưng các nghiên cứu từ năm 1964 trở về sau, tức là sau khi thuốc thalidomide đã bị cấm lưu hành, lại cho ra những kết quả về hiệu lực trị bệnh lạ kỳ của "biệt dược" này.
Đến năm 1991, một nghiên cứu y khoa của giáo sư Gila Kaplan tại Đại học Rockefeller ở New York (Mỹ) cho kết quả thalidomide có tác dụng làm ức chế sự gia tăng của nhân tố alpha tạo khối u (TNF± ) do đó có công dụng tốt trong điều trị bệnh hủi và một số bệnh truyền nhiễm như lao, nhiễm trùng và đặc biệt là bệnh viêm màng nhện tủy.
Năm 1998, sau nhiều nghiên cứu kiểm nghiệm, FDA đã cấp phép cho sử dụng thalidomide trong điều trị bệnh ENL, nhưng kèm theo điều kiện đối với nhà sản xuất. Từ đó, thalidomide được lưu hành trên thị trường với tên thương mại là Thalomid.
Năm 1994, Robert D'Amato tại Trường Y khoa Đại học Harvard đã phát hiện thalidomide có công dụng tốt trong việc điều trị bệnh ung thư tủy xương đa tế bào (multiple myeloma), nhất là khi nó được kết hợp với thuốc dexamethasone. Cách điều trị này hiện nay đã được thay thế bằng một loại thuốc mới an toàn hơn là lenalidomide. Tuy nhiên, cách điều trị bằng thalidomide kết hợp dexamethasone vẫn có công dụng tốt đối với bệnh multiple myeloma giai đoạn khởi phát, và cách điều trị này đã được FDA cấp phép vào năm 2006.
Tuy nhiên, cho dù có công dụng trị bệnh như thế nào thì thalidomide vẫn được khuyến cáo hạn chế sử dụng. Trong một thông báo gần đây, Tổ chức Y tế Thế giới (WHO) cũng khuyến cáo không nên sử dụng thalidomide để điều trị các chứng bệnh như nêu trên.
Theo CAND

