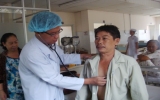
Cho phép tiếp tục được sử dụng trở lại thuốc tiêm Hartame
Ngày 10-1-2014, Cục Quản lý dược đã có công văn 492/QLD-TT gửi Bệnh viện Đa khoa tỉnh Bình Dương và Sở Y tế tỉnh Bình Dương yêu cầu tạm ngưng sử dụng thuốc tiêm chứa hoạt chất Cefotaxim 1g, số đăng ký: VN-8773-09, số lô: 121235, hạn dùng: 19-6-2015 do Công ty Sinochem Ningbo Ltd (Trung Quốc) sản xuất, Công ty JEIL Pharmaceuticals Co.,Ltd đăng ký, công ty trúng thầu Liên doanh Hoàng Long-Thảo Nguyên cung ứng sau khi xảy ra một số phản ứng có hại của thuốc (ADR) nghi ngờ liên quan đến lô thuốc này.
Căn cứ kết quả kiểm nghiệm của Trung tâm Kiểm nghiệm tỉnh và Viện Kiểm nghiệm thuốc TP. Hồ Chí Minh kiểm tra chất lượng thì mẫu thử đều đạt các chỉ tiêu theo tiêu chuẩn đã đăng ký. Theo công văn của Cục Quản lý Dược Bộ Y tế về việc sử dụng thuốc tiêm Hartame (hoạt chất Cefotaxim 1g), số đăng ký: VN-8773-09, Sở Y tế cho phép các đơn vị y tế tiếp tục được lưu hành, sử dụng trở lại thuốc tiêm Hartame chứa hoạt chất Cefotaxim 1g trên. Đồng thời đề nghị các đơn vị (có sử dụng lô thuốc trên) chỉ sử dụng thuốc tiêm Hartame sau khi đã khám sàng lọc, phân loại bệnh nhân, tránh sử dụng thuốc cho những đối tượng bệnh nhân có nguy cơ cao xảy ra ADR; tuân thủ chỉ định, chống chỉ định, thận trọng, liều dùng của thuốc, chú ý tương tác thuốc khi kê đơn thuốc Hartame nêu trên...
LỆ THỦY
- Hà Nội ghi nhận 28 trường hợp mắc sởi mới, đa phần chưa tiêm phòng (25/11)
- Nâng cao kiến thức tình dục an toàn cho giới trẻ: Tránh rủi ro, hậu quả đáng tiếc (25/11)
- TP.Dĩ An: Khám sức khỏe định kỳ cho cán bộ trung cao (25/11)
- Truyền thông, tư vấn giáo dục sức khỏe sinh sản cho học sinh (25/11)
- Thành phố Hồ Chí Minh: Chủ động kiểm soát dịch sởi, sốt xuất huyết gia tăng (23/11)
- Tổ chức Y tế Thế giới duy trì cảnh báo cao nhất về dịch đậu mùa khỉ (23/11)
- Đề xuất các nguồn kinh phí hoạt động công tác xã hội trong bệnh viện (22/11)
- Đông đảo sinh viên tham gia hiến máu tình nguyện (22/11)
 Tâm lý ngại sinh con đang kéo giảm mức sinh xuống thấp
Tâm lý ngại sinh con đang kéo giảm mức sinh xuống thấp
 MTTQ Phường Hòa Phú (Tp.Thủ Dầu Một): Phối hợp khám bệnh định kỳ cho người dân có hoàn cảnh khó khăn
MTTQ Phường Hòa Phú (Tp.Thủ Dầu Một): Phối hợp khám bệnh định kỳ cho người dân có hoàn cảnh khó khăn
 Không khám thai định kỳ, sản phụ bị u buồng trứng quấn thai
Không khám thai định kỳ, sản phụ bị u buồng trứng quấn thai
 Đóng góp khi lành, để dành khi ốm
Đóng góp khi lành, để dành khi ốm
 Bốn thay đổi quan trọng về bảo hiểm y tế có hiệu lực từ 1/7/2024
Bốn thay đổi quan trọng về bảo hiểm y tế có hiệu lực từ 1/7/2024
Tạm đình chỉ hoạt động Trung tâm tiêm chủng TNT Bến Cát
Nắng nóng kéo dài làm tăng nguy cơ nhồi máu cơ tim
 Bảo vệ sức khỏe mùa nắng nóng
Bảo vệ sức khỏe mùa nắng nóng
 Chủ động phòng bệnh đường hô hấp
Chủ động phòng bệnh đường hô hấp
 Đề xuất ba phương án nâng mức đóng bảo hiểm y tế
Đề xuất ba phương án nâng mức đóng bảo hiểm y tế